Marchitez por verticillium - Verticillium dahliae
Nombre común
Marchitez por Verticillium, marchitez por Verticillium en algodón, encueradera del algodonero, verticilosis del albaricoquero.
Estatus fitosanitario
Verticillium dahliae, es un hongo fitopatógeno que de acuerdo a lo dispuesto en la ISPM 8, Determination of pest status in an Area, se encuentra presente sólo en algunas áreas en México, sin embargo no se encuentra bajo control oficial, por lo que no cumple con la definición de plaga cuarentenaria establecida en la ISPM No. 5, Glossary of Phytosanitary Terms.
Situación en México
Verticillium dahliae, se reporta provocando daños en Solanum cardiophyllum Lindl y Solanum ehrenbergii (Bitt) Rydb, dos especies de papa silvestre cultivadas en México (Rodríguez-Alvarado, 2000). Además, Palomo et al. (2003) reportan la presencia de V. dahliae en la localidad de Matamoros, estado de Coahuila, en cultivo de algodón; Avelar et al. (2001) la reportaron en las localidades de Calvillo, Aguascalientes y en Apozol en Zacatecas, en cultivo de guayaba. Aunque al momento no se
tiene ningún reporte de V. dahliae en frutillas (arándano, frambuesa, fresa y zarzamora) en el
país.
El SENASICA a través de la Dirección General de Sanidad Vegetal instrumenta programas y campañas fitosanitarias para prevenir la introducción o dispersión de plagas que puedan afectar a los vegetales, sus productos y subproductos de la agricultura nacional, así como para mejorar o conservar los estatus fitosanitarios en la producción agrícola. El Programa de Vigilancia Epidemiológica Fitosanitaria, tiene el objetivo de determinar la ocurrencia o ausencia de plagas en un área específica. Mediante su operación se registra la situación fitosanitaria de las plagas reglamentadas en campo. Cabe mencionar que Verticillium dahliae se ha colocado dentro de este programa, con la finalidad de determinar su ocurrencia o ausencia en las zonas productoras de berries, en los estados de Jalisco, Michoacán y Colima, México (SENASICA-DGSV, 2014).
IMPORTANCIA ECONÓMICA DE LA PLAGA
Impacto económico
Se ha reportado que los cultivares de fresa son muy susceptibles a la infección por V. dahliae; de tal forma que menos de 2 microesclerocios por gramo de suelo pueden ocasionar un 100% de incidencia de la enfermedad. Asimismo se ha indicado que la marchitez provocada por Verticillium sp. ocasiona pérdidas del 20-30% en el rendimiento de fresa (Subbarao et al., 2007; Subbarao et al., 2000). Por otra parte se sabe que las frambuesas negras son más susceptibles que las rojas, aunque no se tienen cifras exactas de las pérdidas económicas provocadas por el patógeno en estos cultivos.
Impacto económico potencial en México
En México se cultivan frutillas como son arándano, frambuesa, zarzamora y fresa. Éstos cultivos en conjunto ocuparon para el año 2012, una superficie sembrada de 15536.42 ha, con un valor de producción de $5,161,998.21 (SIAP, 2014). Por lo anterior y considerando los daños provocados por V. dahliae, la presencia de esta enfermedad en el país ocasionaría importantes pérdidas en estos cultivos.
DISTRIBUCIÓN
De acuerdo a EPPO-PQR (2014) y CABI (2014), V. dahliae se encuentra distribuida en:
- Africa: Congo, Egipto, Kenia, Madagascar, Malawi, Marruecos, Mozambique, Nigeria, Rwanda, Sudáfrica, Tanzania, Tunez, Uganda, Zambia, Zimbabwe.
- América: Argentina, Brasil (Minas Gerais), Canadá (Columbia Británica, Ontario, Quebec), Chile, Cuba, México, Perú, Trinidad y Tobago, USA (California, Illinois, Kansas, Maryland, Michigan, Nueva Jersey, Nueva York, Ohio, Oregon, Washington, Wisconsin).
- Asia: China (Anhui, Hubei, Hunan, Jiangsu, Jiangsi, Shaanxi, Xinjiang, Yunnan), India (Karnataka, Maharashtra, Rajasthan, Tamil Nadu), Iran, Irak, Israel, Japón, Jordania, República de Corea, Kyrgyzstan, Paquistán, Siria, Tajikistan, Turkmenistan, Uzbekistan.
- Europa: Albania, Armenia, Austria, Azerbaijan, Bélgica, Bulgaria, Chipre, República Checa, Checoslovaquia, Dinamarca, Francia, Alemania, Grecia, Hungría, Italia, Malta, Moldova, Montenegro, Países bajos, Portugal, Rumania, Rusia (Siberia Oriental, Lejano Oriente, Siberia Occidental), España, Suecia, Suiza, Turquía, Ucrania, Reino Unido.
- Oceanía: Nueva Gales del Sur, Queensland, Australia del Sur, Tasmania, Victoria, Australia Occidental, Nueva Zelanda.
HOSPEDANTES
Verticillium dahliae tiene un amplio rango de hospedantes, incluyendo plantas anuales y perennes, herbáceas y leñosas perennes. Se reporta afectando más de 300 especies de plantas pertenecientes a diferentes géneros, entre ellas se reportan a algodón (Gossypium hirsutum), fresa (Fragaria × ananassa), frambuesa (Rubus idaeus), frambuesa americana (Rubus loganobaccus), frambuesa negra (Rubus occidentalis), zarza de California (Rubus ursinus), zarzamora (Rubus fruticosus) (Farr y Rossman, 2014).
ASPECTOS BIOLÓGICOS
Morfología
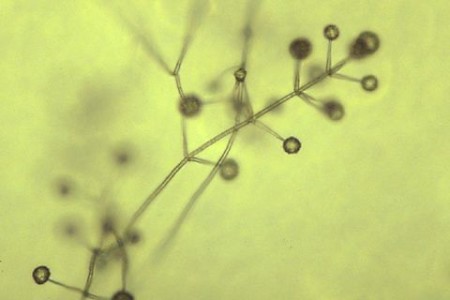
El micelio vegetativo es hialino, septado y multinucleado. Los núcleos son haploides. Los conidios son de forma oval-alargada y normalmente unicelulares. Estos se producen en fiálides, que son hifas especializadas producidas en una espiral alrededor de cada conidióforo. Cada fiálide contiene una masa de conidios. La ramificación de los conidióforos se produce en verticilos (Berlanger y Powelson, 2000; Fradin y Thomma, 2006).
Ciclo biológico
La marchitez provocada por V. dahliae se ve favorecida por suelos húmedos y un rango de temperatura entre 21-27 °C. Los microesclerocios son estimulados a germinar por exudados de las raíces tanto de plantas hospedantes como no hospedantes, las hifas producidos por éstos pueden penetrar la raíz a
través de heridas ocasionadas por insectos, nematodos o directamente. El hongo penetra la raíz en la zona de alargamiento y coloniza la corteza. Desde la corteza, las hifas invaden los vasos del xilema donde forman conidios. La colonización vascular ocurre cuando los conidios son transportados con la savia ascendente.
Debido a los materiales fúngicos y productos de defensa producidos por el hospedante, como son tilosas (crecimiento de células del parénquima adyacentes a vasos del xilema) y goma, el sistema vascular es bloqueado, evitando que el agua llegue a las partes superiores de la planta. La obstrucción vascular ocasiona que tanto hojas como tallos, comiencen a exhibir síntomas de marchitez y clorosis.
Conforme las plantas enfermas envejecen, el hongo produce microesclerocios que son liberados en el suelo con la descomposición de residuos vegetales. El hongo sobrevive durante muchos años en esta forma latente o como micelio o conidios en el sistema vascular de plantas perennes (Berlanger y Powelson, 2000; Steffek et al., 2006).
Síntomas
En hojas: Los síntomas provocados por V. dahliae en fresa incluyen marchitez, clorosis, enanismo, necrosis, o aclaramiento de nervaduras. Las secciones transversales de los tejidos del tallo pueden presentar un tejido vascular color marrón (Frandin y Thomma, 2006). Se observa una coloración marrón en los márgenes y entre las nervaduras de hojas exteriores. Las hojas interiores se atrofian, pero
generalmente permanecen verdes y turgentes hasta que ocurre la muerte de la planta, estas hojas tienden a enrollarse a lo largo de la nervadura central y muestran rayas o manchas de color café negruzco (Figura 4). Este último síntoma a veces ayuda a diferenciar esta enfermedad de la pudrición de la corona provocada por Phytophthora (Zalom et al., 2005; Steffek et al., 2006). Se puede observar también rayas o manchas de color marrón -azul oscuro en los estolones o pecíolos. Las nuevas raíces que crecen de la corona generalmente son pequeñas y con puntas ennegrecidas (Ellis, 2008a).
Los primeros síntomas de marchitez por Verticillium en nuevas plantaciones de fresa con frecuencia aparecen en el periodo en que los estolones empiezan a formarse. En las plantaciones de mayor edad, los síntomas suelen aparecer justo antes de la cosecha. Los síntomas iniciales aparecen a finales de primavera durante períodos de estrés hídrico (alta temperatura, alta intensidad de luz, baja humedad del suelo). Los síntomas tienden a ser más graves en plantas en fructificación. Algunas plantas pueden recuperarse del daño por marchitez, pero nunca podrán recuperar su productividad económica. Los síntomas pueden aparecer en plantas individuales o en grupos de plantas sanas que se encuentran cerca de plantas infectadas (Figura 6). (Gordon y Subbarao, 2008).
En hojas de frambuesa, infestadas por V. dahliae, se observa un color verde pálido u opaco en comparación con el verde intenso de las hojas normales. Posteriormente, las hojas se marchitan, se tornan amarillas y caen. Los síntomas se inician en la base del tallo y progresan hacia arriba del mismo (Ellis, 2008b).
En tallos. Los síntomas provocados por V. dahliae en frambuesa, mora y zarzamora, aparecen al final de la temporada de crecimiento, los tallos se doblan y toman un color azulado. Debido a esta sintomatología, la enfermedad se conoce comúnmente como tallo azul. Se ha reportado que las frambuesas negras son más susceptibles que las rojas (Kenneth, 2013). Los tallos infestados generalmente mueren antes que los frutos maduren, lo que ocasiona frutos pequeños y sin sabor (Ellis, 2008b).
ASPECTOS EPIDEMIOLÓGICOS
Después de que el hospedante muere o la temporada de crecimiento termina, V. dahliae sobrevive como micelio, el cual inverna en residuos vegetales muertos que se encuentran en el suelo; el hongo también puede vivir saprófitamente, exista o no un hospedante disponible. La supervivencia puede ocurrir en
raíces de especies no hospedantes en las cuales no se produce infección sistémica.
Los días fríos y nublados intercalados con días cálidos y luminosos son más propicios para el
desarrollo de la marchitez por V. dahliae. La infección y el desarrollo de la enfermedad ocurren cuando las temperaturas del suelo están entre 12 y 30 °C, con un óptimo entre 21-24 °C.
La marchitez por Verticillium se presenta principalmente en zonas de clima templado. En Illinois, USA, la enfermedad es particularmente grave durante las estaciones frías (Report on Plant Disease, 2001)
Dispersión
Los microesclerocios son capaces de sobrevivir a largo plazo (hasta 15 años), sin contacto con una planta hospedante. Ellos pueden ser introducidos a nuevas áreas por el viento o el agua donde sirven como inóculo. El patógeno también puede diseminarse por semilla contaminada, esquejes vegetativos, trasplantes, tubérculos, brotes, plantas de vivero, cepellones, o raíces desnudas de árboles infectados.
Además, el micelio y microesclerocios pueden ser transportados por las operaciones normales de labranza, herramientas, o maquinaria agrícola. Una vez que establece contacto con un nuevo hospedante, el hongo infecta nuevamente el sistema radical, se desplaza hacia arriba, y se repite el ciclo (Ward y Kaiser, 2013).
MÉTODOS DE DETECCIÓN
Actualmente, se utilizan diversas técnicas moleculares para la detección, monitoreo, cuantificación y estimación de la densidad de propágulos de Verticillium spp., tanto en el suelo como en la planta. Tales técnicas se refieren al uso de la Reacción en Cadena de la Polimerasa (PCR), Restricción de Fragmentos de Longitud Polimórfica (RFLP), Amplificación Aleatoria de Fragmentos de ADN Polimórfico (RAPD) y la Secuenciación de Espacios Intergénicos (IGS) (Collado-Romero et al., 2006; Fradin y Thomma,
2006).
Se ha reportado que el método de PCR resulta ser más sensible que el de aislamiento en medio
de cultivo tanto en muestras sintomáticas como en asintomáticas, para la detección de V. dahliae (Karajeh y Masoud, 2006; Morera et al., 2005).
MUESTREO
El muestreo de V. dahliae en berries se realizará bajo la siguiente metodología de búsqueda en
forma de zig-zag con nueve puntos (Figura 7), considerando una superficie de 1 ha. En cada punto se deben tomar 5 muestras para un total de 45 muestras por zig-zag; en cada lote de producción se realizará el mismo procedimiento; al momento del muestreo el personal encargado debe de considerar los síntomas o daños típicos, ocasionados por el patógeno. Los muestreos se deberán realizar cada dos semanas, desde la siembra hasta la cosecha, esto con la finalidad de detectar oportunamente la enfermedad.
La distribución de los nueve puntos de muestreo dentro del zig-zag, deberán estar asociados a
zonas con los siguientes factores: zonas con humedad alta o inundada, dirección de corrientes de viento, dirección de lámina de riego, prácticas culturales recientes, aplicación de residuos vegetales.
ESTRATEGIAS DE MANEJO Y CONTROL
Control cultural
- Fertilización adecuada para promover el crecimiento vigoroso y mantener un balance de nitrógeno, fósforo y potasio. La fertilización puede ayudar a reducir los síntomas en el vivero y campo.
- Evitar campos utilizados anteriormente con cultivos susceptibles por ejemplo, tomate, pimiento, papa, berenjena, melón, okra, menta, zarzas, frutales de hueso, crisantemos, rosas, entre otros.
- Eliminar malezas que puedan servir como reservorios de inóculo en los alrededores de los sitios de plantación (Report on Plant Disease, 1997; Berlanger y Powelson, 2000).
- Desinfestar todas las herramientas utilizadas durante las actividades de poda con una
solución de alcohol al 70%. - Esterilizar el suelo utilizado para plantas en macetas o para cultivos en bancales en invernadero y vivero, a 82 °C durante 30 minutos o a 71 °C durante una hora también es recomendado.
- La solarización del suelo es una técnica de desinfección que emplea la radiación solar durante los meses de verano para aumentar la temperatura del suelo en un campo, el cual es cubierto con polietileno, y en el que el contenido de agua del suelo se lleva a la capacidad de campo. Esta metodología ha mostrado ser eficaz en el control de patógenos, tales como V. dahliae. Para una solarización exitosa se
requiere de 30-45 días y temperaturas del suelo superiores a 50 °C (Ajwa et al., 2003). - La rotación de cultivos con brócoli y col de Bruselas ha demostrado ser un buen método para reducir el inóculo de V. dahliae en el suelo (Subbarao et al., 2007; Zalom et al., 2005).
Control químico
Los cultivares de fresa susceptibles a V. dahliae pueden cultivarse en campos infestados siempre y cuando se aplique un tratamiento de fumigación al suelo, antes de la siembra. La fumigación del suelo no es una opción recomendable en cultivos de traspatio. El fumigante del suelo más eficaz consiste en una mezcla de cloropicrina (gas lacrimógeno) al 33% y bromuro de metilo 66% (Ellis, 2008a), cabe
mencionar que en la actualidad ya no se recomienda el uso de Bromuro de metilo, por su efecto negativo a l ambiente.
Resistencia genética
El uso de variedades resistentes es uno de los métodos de control más importantes para esta
enfermedad. Para el caso de fresa, varios cultivares han mostrado resistencia natural a V. dahliae, tales como: Allstar; Catskill; Delite; Earliglow; Guardián; Lester; Rechief; De Scott; Sunrise; Surecrop y Tennessee. Las variedades Homenaje y Tristar, también son reportadas como resistentes (Ellis, 2008a).
TAXONOMÍA
Reino: Fungi
Phylum: Ascomycota
Clase: Sordariomycetes
Subclase: Hypocreomycetidae
Orden: Hypocreales
Familia: Incertae sedis
Género: Verticillium
Especie: V. dahliae
BIBLIOGRAFÍA
- Ajwa A.H., Klose S., Nelson D. S., Minuto A., Lodovica G.M., Lamberti F. y J.M. Lopez-Aranda. 2003.
- Alternatives to methyl bromide in strawberry production in the United States of America and the
Mediterranean region. Phytopathol. Mediterr. 42:220–244. - Avelar, M.J.J., Téliz, O.D. y E. Zavaleta. 2001. Patógenos Asociados con El “Declinamiento Del Guayabo”. Revista Mexicana de Fitopatología 19(2): 223-229.
- Berlanger, I. and M. L. Powelson. 2000. Verticillium wilt. The Plant Health Instructor. DOI: 10.1094/PHI-I-PHI-I-2000-0801-01 Updated 2005.
- CABI. 2014. Crop Protection Compendium. En: http://www.cabi.org/cpc/.Consultado el 4
de junio 2014. - Collado-Romero, M., Mercado-Blanco, J., Olivares-Garcia, C., Valverde-Corredor, A., y R.M. Jimenez-Diaz. 2006. Molecular variability within and among Verticillium dahliae vegetative compatibility groups determined by fluorescent amplified fragment length polymorphism and polymerase chain reaction markers. Phytopathology 96:485–495.
- Ellis A. M. 2008a. Verticillium Wilt of Strawberry. Fact Sheet HYG-3012-08. Agriculture and Natural Resources. Ohio State University Extension. 2p.
- Ellis, A. M. 2008b. Verticillium Wilt of Raspberry. Fact Sheet HYG-3027-08. Agriculture and Natural Resources. Ohio State University Extension. 2p.
- EPPO-PQR. 2014. Data base on quarantine pests. En: http://www.eppo. Int. Consultado el 9 de junio 2014.
- Farr, D. F. and A. Y. Rossman. 2014. Fungal Databases, Systematic Mycology and Microbiology Laboratory, ARS, USDA. En: http://nt.ars-grin.gov/fungaldatabases. Consultado: 09 de junio 2014.
- Fradin, E. F., and B. P. Thomma. 2006. Physiology and molecular aspects of Verticillium wilt diseases caused by V. dahliae and V. albo-atrum. Mol. Plant Pathol. 7(2):71-76.
- Gordon, T. R. and K. V. Subbarao. 2008. Verticillium Wilt of strawberry. Production guidelines 1.1. California Strawberry Commission. En: www.csc.com. Consultado: 9/06/2014.
- IPPC.2011d. International Standards for Phytosanitary Measures (ISPM) 8 Determination of Pest Status in an Area. International Plant Protection Convention (IPPC). En: https://www..ippc.int/coreactivities/standars-settings/ispm. Consultado: 10 de junio 2014.
- IPPC.2011d. International Standards for Phytosanitary Measures (ISPM) 5 Glossary of phytosanitary terms (2012). International Plant Protection Convention (IPPC). En: https://www..ippc.int/sites/default/files/documents//1345210416_ISPM_05_Es_2012-08-17_BasedOn201.pdf. Consultado: 10 de
junio 2014. - Karajeh, M.R and S.A. Masoud. 2006. Molecular detection of Verticillium dahliae Kleb. in asymptomatic olive trees. Journal of Phytopathology 154: 496-499.
- Kenneth, H.R. 2013. Wilt Diseases. Westcott’s Plant Disease Handbook, 8th ed. © Springer Science+Business Media Dordrecht. pp. 440-443.
- Morera, B., Páez, J. I., Vega J.Ma. y F. Montes. 2005. Comparación de métodos de diagnóstico de Verticillium dahliae en olivo: aislamiento en medio de cultivo y PCR. Bol. San. Veg. Plagas 31: 267-275.
- Palomo, G.A., Godoy, A.S., Gaytán, M.A. y E.A. García. 2003. CIAN PRECOZ: Variedad de Algodón de ciclo corto y tolerante a la enfermedad “Secadera tardía” (Verticillium dahliae K.). Revista Fitotecnia Mexicana 26(2): 131–132.
- Report on Plant Disease. 1997. Verticillium Wilt Disease. RPD No. 1010. Department Of
Crop Sciences University Of Illinois At Urbana-Champaign. 7p. Report on Plant Disease. 2001. - Verticillium Wilt Of Strawberry. RPD No. 707. Department Of Crop Sciences. University Of Illinois Extension. 4p.
- Rodríguez-Alvarado, G., Fernández-Pavía, S.P., J. Galindo-Alonso.2000. First Report of Verticillium dahliae Causing Wilt on Solanum cardiophyllum and Solanum ehrenbergii. Plant Disease 84(7): 808.3-808.3.
- SIAP. 2014. Anuarios Estadísticos de la Producción Agrícola en México. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación.Pesca y Alimentación. Versión electrónica En: http://www.siap.gob.mx. (Consultada 9 de junio 2014).
- SENASICA-DGSV (Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria-Dirección General de Sanidad Vegetal). 2014. Programa de Vigilancia Epidemiológica Fitosanitaria. En:
http://www.senasica.gob.mx/?id=4155. (Consultada 9 de junio 2014). - Steffek R., Spornberger, A. y J. Altenburger. 2006. Detection of Microsclerotia of Verticillium dahliae in Soil Samples and Prospects to Reduce the Inoculum Potential of the Fungus in the Soil. Agriculturae Conspectus Scientificus 71 (4): 145-148.
- Subbarao, K.V., Martin, F.N. y K. G. Shetty. 2000. Rotations with Broccoli – A Sustainable Alternative to Soil Chemical Fumigants. Pest Management Grants Final Report. California Department of Pesticide Regulation. 18 p.
- Subbarao, K. V., Kabir, Z., Martin, F. N., and Koike, S. T. 2007. Management of soilborne diseases in strawberry using vegetable rotations. Plant Dis. 91:964-972.
- Ward, A. N. and C. H. Kaiser. 2013. Verticillium wilt of woody plants. Plant Pathology Fact Sheet. PPFS-OR-W-18. Cooperative Extension Service. University of Kentucky-College of Agriculture. 3 p.
- Zalom, F. G., Koike, S.T. y B.B. Westerdahl. 2005. Guía para el manejo de las plagas: fresas. Trad. Riesa Bigelow. Publicación 3473. Universidad de California Manejo Integrado de Plagas—FRESAS. 70 p.
TOMADO DE:
GSV-CNRF. 2014. Marchitez por Verticillium, Verticillium dahliae. Dirección General de Sanidad Vegetal- Centro Nacional de Referencia Fitosanitaria. Ficha Técnica. México, Distrito Federal. 16 p.
Elaborado por:
Grupo Especialista Fitosanitario
- M.C. Lázaro-Dzul M.O.
- Dr. Quezada-Salinas A.
- Dr. García-Avila C. J.
Más imágenes sobre Marchitez por verticillium:
- Marchitez por verticillium (Verticillium dahliae) - Primeros síntomas de la enfermedad: retraso del crecimiento y clorosis en las hojas inferiores
- Marchitez por verticillium (Verticillium dahliae) - Decoloración moteada del tejido vascular
- Marchitez por verticillium (Verticillium dahliae) - Fiálides de Verticillium sp. / Créditos: http://www.apsnet.org/